A Doença de Chagas, também conhecida como tripanossomíase americana, é uma infecção causada pelo protozoário Trypanosoma cruzi e transmitida principalmente pelo inseto popularmente chamado de “barbeiro”. Embora seja uma condição tropical negligenciada por muitos anos, ela continua afetando milhões de pessoas na América Latina, e uma das suas principais e mais graves consequências é no coração.
Então, neste artigo, você vai entender como a Doença de Chagas se manifesta, quais são suas complicações cardíacas, quando buscar ajuda médica e quais são os tratamentos disponíveis.
O que é a Doença de Chagas?
A infecção pelo Trypanosoma cruzi ocorre principalmente por meio da picada do barbeiro, mas também pode ser transmitida por transfusões de sangue contaminado, transplantes de órgãos, da mãe para o bebê ou por ingestão de alimentos contaminados, como a cana de açúcar e o açai, especialmente se prensados
Ela possui duas fases:
- Fase aguda: geralmente assintomática ou com sintomas leves, como febre, mal-estar e inflamação no local da picada. Muitas vezes, a fase aguda da doença de Chagas mimetiza uma infecção ou virose comum, que passa despercebida pelo paciente e pela família.
- Fase crônica: pode se manter silenciosa por décadas, mas cerca de 30% e 40% dos pacientes desenvolvem complicações cardíacas graves. Na forma crônica, são 3 as principais formas clínicas: a cardiopatia Chagásica, ou acometimento cardíaco, a forma digestiva – que envolve principalmente o esôfago e o intestino, acometendo cerca de 18% dos pacientes – e a forma mista, que combina as formas cardíaca e digestiva. Existe ainda uma forma denominada de tromboembólica, que ocorre quando o paciente tem a formação e migração de trombos ou coágulos, para órgãos como o cérebro (AVC) e outros órgãos.
- Quando o paciente não manifestou nenhuma forma clínica até o presente momento, dizemos que o mesmo encontra-se na fase indeterminada da doença.
Doença de Chagas e complicações cardíacas
A forma cardíaca crônica da doença é a principal causa de morbidade e mortalidade entre os pacientes com Doença de Chagas. Assim, as manifestações mais frequentes incluem:
1. Miocardiopatia chagásica
É uma inflamação e degeneração progressiva do músculo cardíaco, que leva à falência da função contrátil. Com o tempo, o coração dilata e se torna incapaz de bombear o sangue adequadamente, sendo esta uma das principais causas de insuficiência cardíaca em países Latino-americanos.
2. Arritmias
Alterações na condução elétrica do coração são comuns. Isto é, podem surgir bradicardias (batimentos lentos), taquicardias ventriculares ou bloqueios atrioventriculares. Isso pode, então, levar a síncopes (desmaios) e até a formas mais graves, como a morte súbita.
3. Insuficiência cardíaca
Com o enfraquecimento do músculo cardíaco, o coração perde sua capacidade de manter a circulação sanguínea adequada, resultando, assim, em cansaço extremo, falta de ar e inchaço nas pernas. Em geral é uma fase tardia da miocardiopatia chagásica, com envolvimento difuso e grave do coração.
4. Tromboembolismo
A presença de áreas com contração cardíaca anormal facilita a formação de coágulos, que podem se desprender e causar acidentes vasculares cerebrais (AVC) ou embolias pulmonares e para outros órgãos do corpo..
5. Aneurisma de ventrículo esquerdo
É uma deformidade na parede do ventrículo que pode aumentar o risco de ruptura, arritmias e trombose.
Como é feito o diagnóstico?
O diagnóstico da Doença de Chagas envolve exames sorológicos para detecção do Trypanosoma cruzi e, em caso de suspeita de complicações cardíacas, é necessário:
- Eletrocardiograma (ECG)
- Ecocardiograma
- Holter 24h
- Ressonância magnética cardíaca
- Teste ergométrico
- Exames laboratoriais
Tratamento das complicações cardíacas da Doença de Chagas
Embora o tratamento com antiparasitários seja indicado na fase aguda ou em fases iniciais da forma crônica, em pacientes mais jovens, os pacientes com envolvimento cardíaco exigem uma abordagem mais ampla e contínua.
As opções incluem:
- Medicamentos para insuficiência cardíaca (inibidores da ECA, betabloqueadores, diuréticos)
- Antiarrítmicos
- Anticoagulantes (em casos com risco de tromboembolismo)
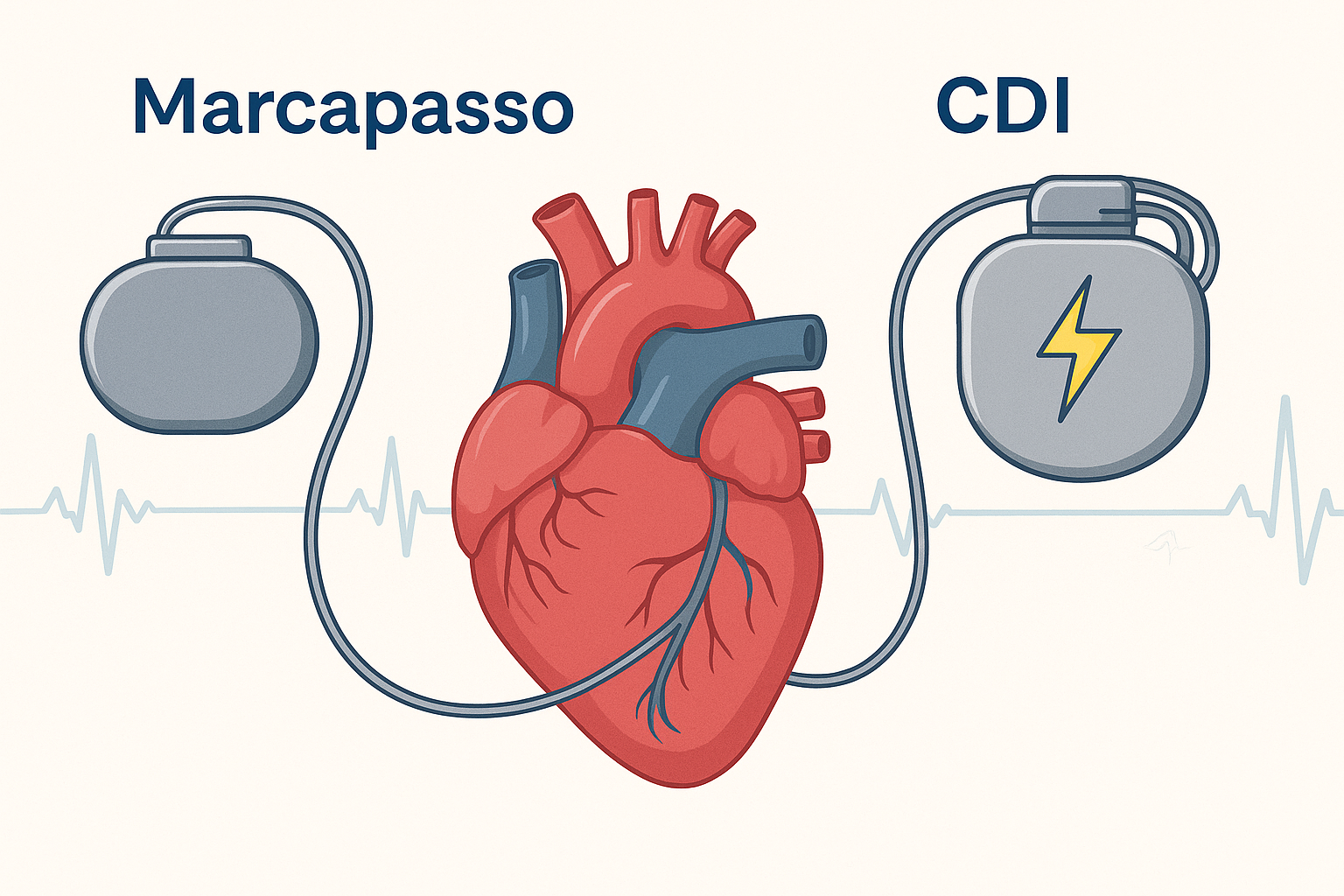
- Implante de marcapasso (em casos de bloqueios cardíacos)
- CDI – cardiodesfibrilador implantável (em casos de risco de morte súbita por arritmias)
- Transplante cardíaco (em casos graves e refratários ao tratamento clínico)
Quando procurar um cardiologista?
Qualquer pessoa com histórico de Doença de Chagas, mesmo sem sintomas, deve passar por uma avaliação cardiológica periódica. Os sinais de alerta incluem:
- Palpitações
- Falta de ar aos esforços
- Inchaço nas pernas
- Tonturas ou desmaios
- Cansaço extremo
O papel da prevenção e acompanhamento
A prevenção da Doença de Chagas está relacionada ao controle do vetor e medidas de vigilância sanitária, além da melhora das condições socioeconômicas e de moradia. Mas, para quem já foi exposto ou diagnosticado, o acompanhamento médico é fundamental para evitar a progressão da doença e minimizar complicações.
Algumas medidas são fundamentais para evitar ou lentificar a progressão para formas mais graves, como a realização seriada do ECG, realização do ecocardiograma quando há sinais clínicos ou alterações importantes ao ECG, realização de monitorização com o Holter para avaliação da frequência e gravidade de arritmias, etc.
Doença de Chagas e o coração: cuidar é preservar a vida
A Doença de Chagas e suas complicações cardíacas exigem atenção constante, especialmente na fase crônica, quando os sintomas podem surgir de forma insidiosa, mas com consequências potencialmente fatais.
Se você já teve contato com o barbeiro, possui histórico familiar ou foi diagnosticado com Doença de Chagas, agende sua avaliação no Centro de Cardiologia do Hospital Madre Teresa. Nossa equipe especializada está pronta para oferecer atendimento de excelência, com tecnologia de ponta, diagnóstico preciso e tratamento humanizado.
Acesse nossas redes sociais, como Instagram e, claro, acesse nosso blog para ler mais conteúdos como esse.
Até o próximo!