Contribuição do teste ergometrico em ECG suspeito de Síndrome de Brugada – relato de caso

Dra Samira Sodre Picheli (Ergometrista do Setor de Métodos Complementares do Hospital Madre Teresa )
A Síndrome de Brugada ( SB) foi descrita pela primeira vez há mais de 25 anos como uma entidade clínica presente em pessoas ressuscitadas de morte súbita em decorrência de Fibrilação Ventricular (FV). Uma série de casos em 1992 com 8 pacientes ,sem cardiopatia estrutural e ECG com supra de ST após FV , foi descrito em 1992 pela 1ª vez. Trata-se de uma canalopatia genética em que estão envolvidas mutações dos canais de sódio.
A Síndrome de Brugada ( SB) foi descrita pela primeira vez há mais de 25 anos como uma entidade clínica presente em pessoas ressuscitadas de morte súbita em decorrência de Fibrilação Ventricular (FV). Uma série de casos em 1992 com 8 pacientes ,sem cardiopatia estrutural e ECG com supra de ST após FV , foi descrito em 1992 pela 1ª vez. Trata-se de uma canalopatia genética em que estão envolvidas mutações dos canais de sódio.
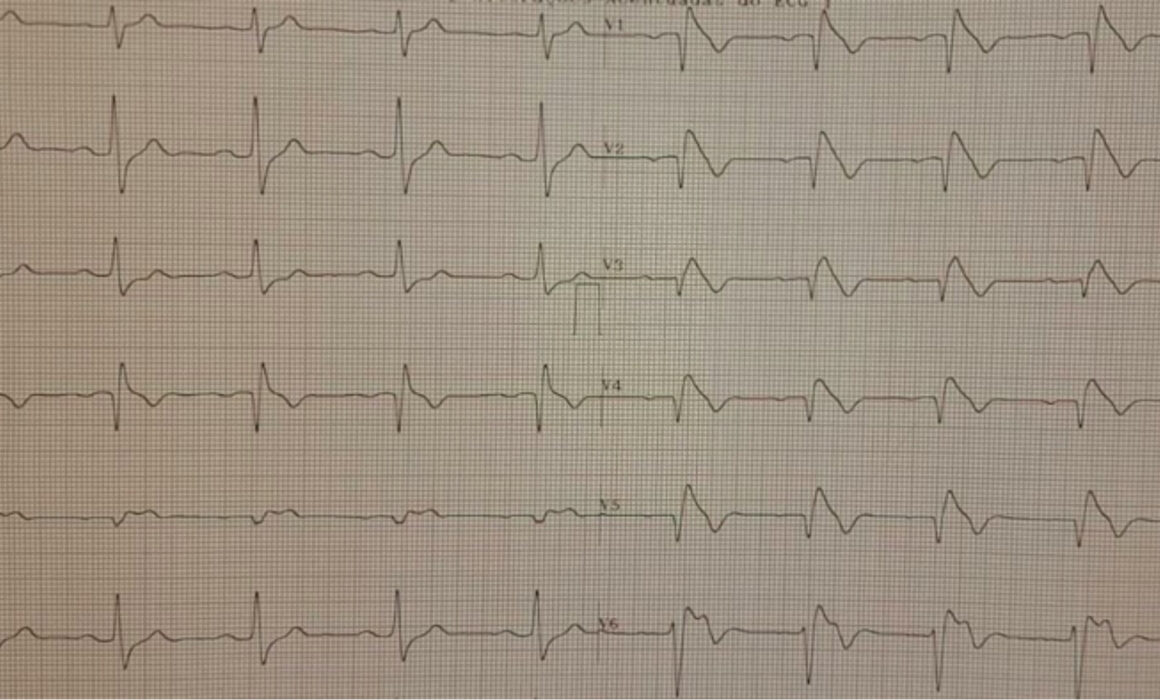
Diferentes condições clínicas podem se apresentar com ECG parecido ao da SB ( fenocopias), devendo ser excluídas com propedêutica específica e dados da história clinica . De acordo com consenso de 2013 sobre arritmias cardíacas hereditárias e o guidelines de 2015 sobre morte súbita, SB é diagnosticado em pacientes com elevação de segmento ST de ≥ 2.0mm (tipo 1) ou ≥ 1.0mm (tipo 2 ou 3 ) em pelo menos 1 derivação precordial direita (V1,V2) e cujo eletrodo esteja posicionado no 2º ou 3º ou 4º espaço intercostal, ocorrendo espontaneamente ou após teste farmacológico ( Ajmalina).
Sua incidência verdadeira não é bem definida devido a alta variabilidade de apresentação, casos assintomáticos e flutuações morfológicas no ECG diagnóstico. É responsável por > 10% dos casos de MS e até 20% dos casos em corações estruturalmente normais. A prevalência é 8 a 10 vezes maior no sexo masculino. Há diversidade na taxa de eventos arrítmicos documentados (0.4 – 14%) em assintomáticos na literatura devido a heterogeinidade de grupos estudados, limitação de números de pacientes e diferentes tempos de seguimento. A maioria dos pacientes apresentam-se assintomáticos ( cerca de 63%) dentre os novos casos de SB, com taxa anual relatada de 0.5% a 1.2%, resultando em 12% de eventos arrítmicos malignos na taxa de 12% em 10 anos de seguimento em população com idade média de 40 anos. Está bem definida a indicação de implante de cardioversor desfibrilador implantável ( CDI) naqueles recuperados de morte súbita ou TV/FV registrada ou com síncope de origem arrítmica. Infelizmente, alguns pacientes tem como primeira manifestação de sintomas a MS.
Nem sempre é fácil entender a real natureza da sincope em alguns pacientes com SB. Tanto a sincope neuromediada quanto arrítmica na SB têm em comum uma susceptibilidade de tônus vagal. Alta incidência de Tilt Test positivo tem sido demonstrada mesmo em pacientes assintomáticos com SB . O aumento do tônus vagal desmascarando ou exacerbando sinais da SB ao ECG pode ser feito de várias formas além do Tilt Test, como a fase de recuperação do teste ergométrico e o teste do “estômago cheio” . Neste último, refeições volumosas ,principalmente após período de jejum prolongado, refletem alterações na modulação autonômica. A influência vagal na SB é consistente com relatos prévios da ocorrência mais freqüente de FV no período do sono do que na vigília ( 87% x 13%). Síncope em combinação com ECG tipo 1 da SB espontâneo é universalmente aceito como fator de risco porque estudos prévios mostraram a recorrência do sintoma e MS em seguimento de até 48-84 meses após a primeira manifestação sincopal. Porém outro estudo de sincope arrítmica (MS abortada) vs não arrítmica, com detalhamento da história clinica , aqueles com sintoma de característica neuromediada não apresentaram evento de MS em 54 meses de seguimento.
Desta forma, a estratificação de risco dos assintomáticos sob risco maior de MS é um desafio clínico e apresenta pontos pouco elucidados na área de arritmia clinica. Exames não invasivos tem sido estudados como marcadores de risco mas , na sua maioria, são baseados em estudos observacionais com necessidade de validação em amostras maiores. Vários são os marcadores de risco em ECG de SB na investigação não invasiva : fragmentação de QRS, associação de padrão tipo 1 de SB e de repolarização precoce em derivações ínfero-laterais, alterações dinâmicas do ponto J e segm ST, presença de potenciais tardios ao ECG-AR, micro-alternância de ondas T, inervalo T peak- T end , porém como no Teste Ergométrico, devem ser associados à história clinica e outros fatores de risco clássicos na estratificação de risco da SB que é uma síndrome arritmogênica heterogênea em sua apresentação.
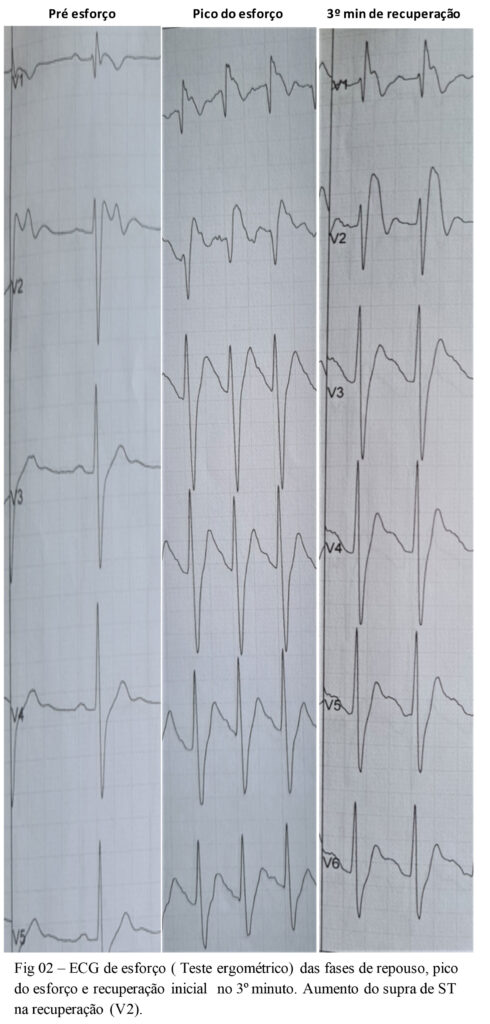
Sabe-se , pela literatura já publicada , que o esforço físico aumenta ou desmascara os sinais da SB ao ECG na fase de recuperação, podendo inclusive ocorrer TV nesse período, em virtude da redução do tônus simpático e predomínio vagal. O aumento da duração do complexo QRS durante esforço físico pode ser atribuído ao acúmulo de canais de sódio mutantes na fase lenta inativa , resultando num estado de menor velocidade de ascensão e condução intraventricular mais lenta. Este mecanismo é corroborado por relatos de alargamento do QRS durante o esforço em pacientes em uso de Flecainida. Alguns estudos observaram que a duração aumentada de onda S e intervalo R-J em derivações precordiais são mais freqüentes em pacientes sintomáticos com SB. Na presença de SB, onda R proeminente em aVR pode refletir condução lentificada em ventrículo direito, heterogeinidade ventricular e subseqüente maior risco de eventos arrítmicos.A elevação do ponto J em aVR no período de recuperação teria valor preditor significativo como preditor de risco arrítimico futuro. Isso poderia ser explicado pelas diferenças regionais na velocidade de condução e concentração de íons cálcio no epicárdio da via de saída de VD deflagrando circuitos reentrantes. Outros estudos , mostram alterações dinâmicas durante o esforço físico , mostrando que a relação da duração da ascensão da onda S em relação à duração total do QRS no pico do esforço seria um preditor de risco de arritmia em longo prazo (média de 77.9±28.9meses) .Neste mesmo estudo, análise por regressão Cox identificou como fatores preditores independentes para ocorrência de eventos maiores de arritmia (MS ressuscitada ou FV ressuscitada) durante seguimento de pacientes assintomáticos com ECG de SB tipo I : aumento da relação da duração da ascensão da onda S em >30% no pico do esforço (p=0.023) , aumento da elevação do ponto J em aVR > 2mm em recuperação tardia (p=0.011) e FC de recuperação reduzida (p=0.042) com modelo de regressão de coorte de boa acurácia (especificiadade de 98.4% e sensibilidade de 62.5%) e poder discriminatório (AUC=0.93, 95% IC 0.89-0.96, p=0.002). Análise de Kaplan-Meyer mostrou progressivo aumento de eventos maiores de arritmia se presentes um fator (1.57%), 2 fatores (42.9%) ou 3 fatores preditores (80%). Nenhum evento arrítmico maior ocorreu naqueles sem qualquer desses fatores de risco preditores . Em outro estudo , Makimoto et al. Sugeriram que o aumento de segm ST em recuperação inicial do Teste Ergométrico pode ser um preditor de pior prognóstico em portadores de SB e história de sincope. Em revisão de literatura sobre esforço físico e SB, supra de ST na recuperação ocorreu em 57% dos pacientes , predominantemente na fase inicial e , em 170 pacientes com a síndrome, apenas 3 apresentaram TV pós esforço.
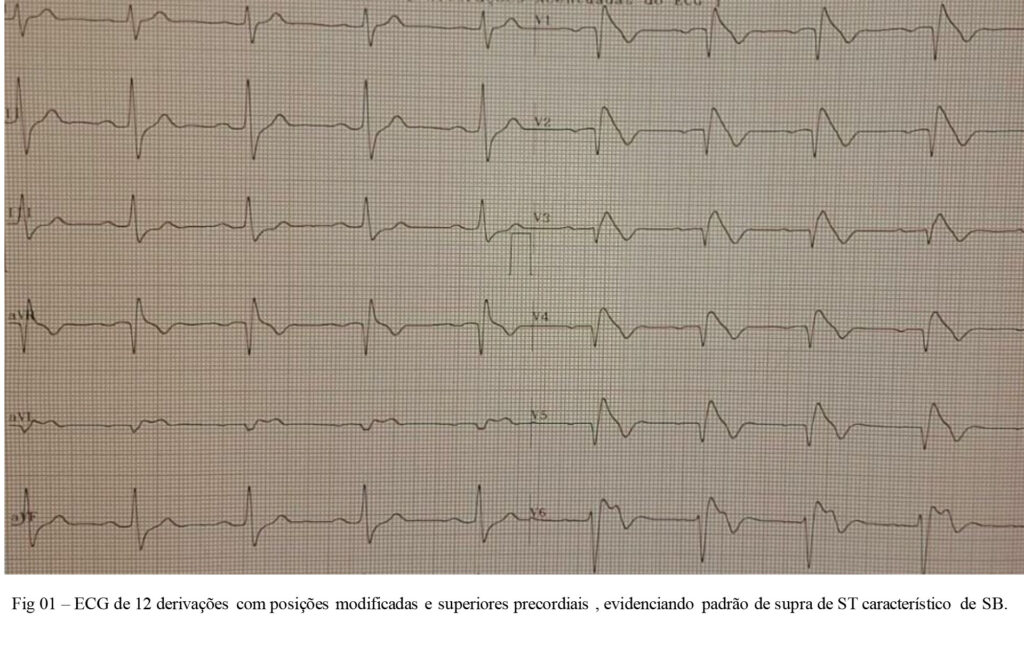
Assim, mostramos abaixo um caso clínico de paciente de 33 anos, sexo masculino, sem cardiopatia estrutural , com ECG com características da SB e submetido a Teste Ergométrico com história de síncope de característica não arrítmica ( história clinica :tipo de gatilho, presença de pródromos e recuperação imediata ). ECG basal com derivações modificadas (fig 1) e das fases do Teste Ergométrico (fig 2) são mostrados abaixo .
Referências :
- Masrur S, Memon S, Thompson PD. Brugada syndrome, exercise, and exercise testing. Clin Cardiol. 2015 May;38(5):323-6
- Subramanian M, Prabhu MA, Harikrishnan MS, Shekhar SS, Pai PG, Natarajan K. The Utility of Exercise Testing in Risk Stratification of Asymptomatic Patients With Type 1 Brugada Pattern. J Cardiovasc Electrophysiol. 2017 Jun;28(6):677-683.
- Batra AS, Watson R, McCanta AC. Exercise-induced syncope and Brugada syndrome. Ann Pediatr Cardiol. 2019 Sep-Dec;12(3):292-294.
- Jayasuriya C, Whitman M. Exercise-induced Brugada sign. Europace. 2011 Mar;13(3):446-7.
- Tomé G, Freitas J. Induced Brugada syndrome: Possible sources of arrhythmogenesis. Rev Port Cardiol. 2017 Dec;36(12):945-956. English, Portuguese.
- Coppola G, Corrado E, Curnis A, Maglia G, Oriente D, Mignano A, Brugada P. Update on Brugada Syndrome 2019. Curr Probl Cardiol. 2019 Aug 23:100454.
- García-Fuertes D, Villanueva-Fernández E, Crespín-Crespín M, Puchol A, Pachón M, Arias MA. Type 1 Brugada Pattern Unmasked During the Recovery Period of an Exercise Stress Test. Arq Bras Cardiol. 2016 May;106(5):447-9.
- Asvestas D, Tse G, Baranchuk A, Bazoukis G, Liu T, Saplaouras A, Korantzopoulos P, Goga C, Efremidis M, Sideris A, Letsas KP. High risk electrocardiographic markers in Brugada syndrome. Int J Cardiol Heart Vasc. 2018 Mar 8;18:58-64.
- Subramanian M, Prabhu MA, Harikrishnan MS, Shekhar SS, Pai PG, Natarajan K. The Utility of Exercise Testing in Risk Stratification of Asymptomatic Patients With Type 1 Brugada Pattern. J Cardiovasc Electrophysiol. 2017 Jun;28(6):677-683